关于我们
一、临床试验中心简介:暂无
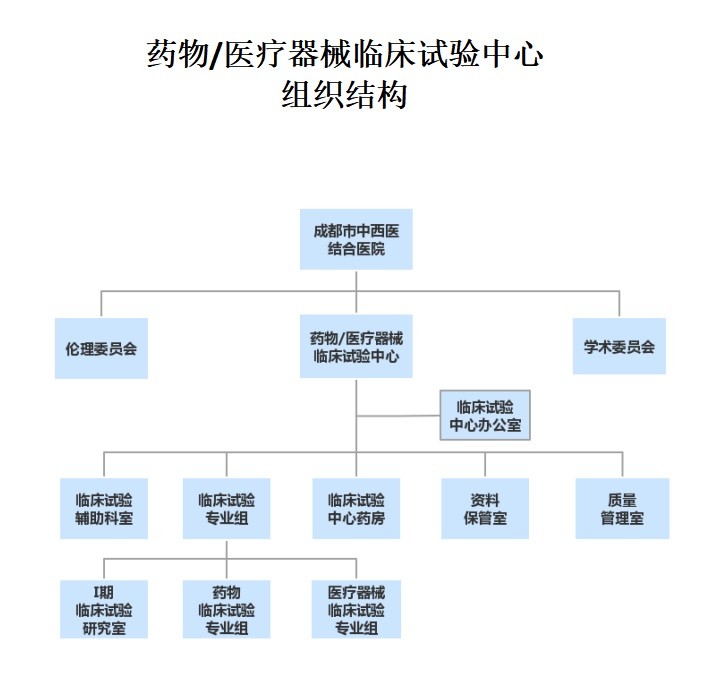
二、临床试验中心组织结构
三、临床试验中心运行流程
1:确定承接项目专业/科室及主要研究者(PI)
申办者若有意在我临床试验中心开展药物/器械临床试验,请首先与中心办公室就承接该临床试验的专业/科室及PI等相关事项进行商洽并确定。
2:递交临床试验立项材料
申办者按照“药物/器械临床试验递交资料列表”要求准备立项材料(2份),递交中心办公室(联系电话:028-85316270),经秘书清点文件齐全后,开具受理回执。
3:项目立项审查
中心办公室主任组织相关人员对送审材料进行立项审核,填写《药物/器械临床试验立项审核表》,出具《药物/器械临床试验立项审批表》报机构主任审批,由中心办秘书将立项审批表(复印件)同立项材料(1份)转交伦理委员会秘书处。
4:伦理委员会审批(相关事宜请与伦理委员会秘书接洽)
由医院伦理委员会对项目进行伦理审查,将伦理审批意见交机中心办公室备案。
5:通过的临床试验项目签署协议/合同
申办者初拟协议/合同(临床试验中心模板/申办方模板),交临床试验中心办公室,办公室组织申办方、专业组负责人、PI具体商谈合同细节、明确合同参与各方的权利和义务、研究费用、知识产权、违约处理等,各方确定内容无误后按“临床试验合同/协议管理制度”的规定进入签署流程。
6:临床试验启动会的召开
由申办者负责召集, PI主持本中心临床试验项目启动会,对GCP相关法规、试验方案及SOP进行培训,所有授权参与该项目的人员均应参加启动会。
7:临床试验材料及药物/器械的交接
(1) 申办者应及时将临床试验材料交项目组。
(2) 临床试验用药物按照“试验药物接收、保存、分发、回收、退还的SOP”送至临床试验中心药房(电话:028- 85316270)。
(3) 临床试验用器械按照“试验器械接收、保存、分发、回收、退还的SOP”送至项目实施科室。
8:临床试验项目实施
(1) 项目管理实行申办者/ PI负责制,申办者/ PI对研究全过程负责。
(2) 项目组遵照GCP、现行法规、试验方案及相关SOP,实施临床试验。
(3) 申办者负责派出合格的,研究者所接受的监查员(CRA)。
(4) 中心将对试验项目质量、项目进度进行监督管理,对存在的问题提出书面整改意见,研究者予以整改并给予书面答复。
(5) 在项目实施过程中,若发生方案违背,研究者应及时报告PI、申办者、伦理委员会,并采取相应的处理措施。
(6) 在项目实施过程中,除临床试验方案或其他文件(如研究者手册)中规定不需立即报告的严重不良事件(SAE)外,若发生SAE,研究者应按照相关的SOP积极处理,并立即书面报告申办者,由申办者按要求上报相关部门。
(7) 项目实施过程中如遇管理部门或申办者发出检查/稽查通知,本项目的相关人员应积极配合,做好准备接受检查/稽查,并将检查/稽查结果交中心办公室备案。
(8) 若临床试验实施超过1年,申办者须向中心办公室递交年度总结报告和项目进展报告。
9:总结报告的撰写与审核
(1) 若本中心为组长单位, PI组织项目组进行资料收集,召开总结会议并撰写总结报告;若本中心为参加单位, PI组织研究人员进行项目总结,撰写分中心总结报告。
(2) 申办者将总结报告递交至中心办公室,按“临床试验项目结题签认表”完成每项工作并签字确认后,交中心办主任审核、盖章。
10:药物/器械回收与资料归档
(1) 项目结束后,按照“试验药物接收、保存、分发、回收、退还的SOP物接收试验器械接收、保存、分发、回收、退还的SOP械清点剩余药物/器械,退还申办者。
(2) 项目结束后,按照“资料档案管理SOP案,研究者、研究助理及监查员将试验资料及时整理归档,递交中心办公室保存,资料保存期限按《药物或医疗器械临床试验质量管理规范》的规定及签订的合同/协议执行。